Het zeta-potentiaal belangrijke spul voor nanobellen
Waarom is de zeta-potentiaal belangrijk voor nano bubbels
De elektrische eigenschappen van gasbellen zijn belangrijk bij het bepalen van de interactie van nano bubbels als en wanneer ze samenvloeien en hoe ze interageren met andere materialen zoals vaste deeltjes of oliedruppeltjes. Kennis hierover helpt bij de ontwikkeling van toepassingen in bijvoorbeeld eiwitafschuimers, schuimopdrijving, voedselverwerking, wassen oppervlakken en zuivering.
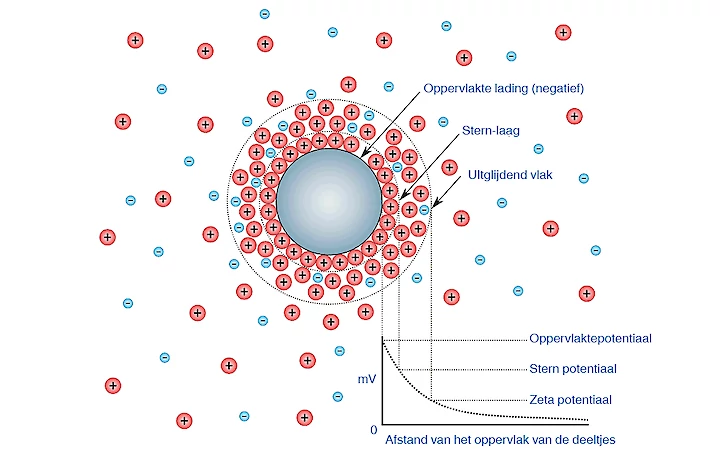
Elektrische dubbele laag rond ultrafijne bubbel
Wanneer een bubbel in een vloeistof hangt, wordt deze omgeven door tegengesteld geladen ionen. De omgeving van de nano bubbel bestaat uit twee delen. Een binnenste, nabije regio genaamd de Stern-laag waar de ionen sterk gebonden zijn en een buitenste diffuse regio waar de ionen minder stevig vastzitten. Het buitenste gebied is als een wolk die bij elkaar wordt gehouden door elektrostatische krachten; het bestaat uit verschillende ionen met tegengestelde polariteiten. Het hele systeem vormt een elektrische dubbellaag. De ontwikkeling van een netto lading aan het vloeibare oppervlak van het bubbeldeeltje beïnvloedt de distributie van ionen in het naburige interfacegebied. Dit resulteert in een verhoogde concentratie van tegenionen dicht bij het oppervlak. Wanneer de nano bubbel door de vloeistof beweegt, bewegen ionen binnen de grens met de bel mee. Alle ionen buiten de grens bewegen niet mee met de bubbel. De grens noemen we de hydrodynamische schuifkracht of het glijdende vlak. Het potentiaal op dit oppervlak wordt het zetapotentiaal genoemd.
Hoog en laag zeta potentiaal
Het Zeta-potentiaal kan worden gemeten in mV. Het Zeta- potentiaal meet de omvang van de afstoting of aantrekkingskracht van de elektrostatische lading tussen deeltjes, bubbels of druppels. Zeta-potentiaal is een van de fundamentele parameters om de stabiliteit te beïnvloeden. Het Zeta- potentiaal geeft gedetailleerd inzicht in de oorzaken van dispersie, aggregatie of flocculatie en kan worden toegepast om de formulering van dispersies, emulsies en suspensies te verbeteren.
H + en OH-ionen

Hogere zetapotentiaal betekent stabiliteit van nano bubbels in suspensie als gevolg van afstoting tussen de bubbels. Een lager zetapotentiaal leidt tot coagulatie en is minder stabiel. Een lager zeta-potentiaal betekent een waarde die dichter bij nul ligt. De zeta-potentiaal is positief of negatief en een hoog zeta-potentiaal kan een hoog positief of hoog negatief getal zijn om stabiel te zijn. De lading van de oplossing hangt af van positieve ionen H+ of meer negatieve ionen OH-. Studies hebben aangetoond dat bubbels in gedestilleerd water negatief geladen zijn. Gemiddeld heeft een bubbel in gedestilleerd water een zetapotentiaal van -35 mV bij een pH van 5,8 bij het meten van verschillende belgroottes is er geen verband tussen de grootte van de zetapotentiaal en de bubbeldiameter.
Als H+ en OH- ionen in het spel zijn, is de pH ook aanwezig en een belangrijke factor, dus doe dit bij het meten van de zetapotentiaal altijd in combinatie met de pH. Als de zetapotentiaal negatief is, wordt de gas-water interface negatief geladen met OH-ionen. Het water heeft een overmaat aan OH-ionen in vergelijking met H+ -ionen. De negatieve waarde van de zeta-potentiaal onder een breed pH-bereik suggereert dat OH- effectiever aan het grensvlak wordt geadsorbeerd dan H+. Soms is de zetapotentiaal positief, dit gebeurt d.w.z. onder sterkere zure omstandigheden, d.w.z. wanneer CO2-gas wordt opgelost.
Onderzoekers verklaarden de adsorptie van OH- op het grensvlak door het verschil in hydratatie-energie tussen H+ en OH- of door de oriëntatie van waterdipolen op het grensvlak met waterstofatomen die naar de waterfase wijzen en zuurstofatomen naar de gasfase, waardoor een aantrekkingskracht ontstaat anionen voor de tussenfase.
De elektrische lading van de gas-waterinterface is gerelateerd aan het waterstofbindende netwerk van water. De elektrische lading van de interface in de waterige oplossing wordt veroorzaakt door een grotere overmaat aan H+ en OH- aan de interface dan in de bulk. Deze ionen zijn de essentiële elementen van het waterstofbindingsnetwerk en daarom moet de structurele informatie van de gas-waterinterface een groter aantal van deze ionen aan de interface bevatten dan in de bulkwaterfase. Aangezien de negatieve waarde van de zetapotentiaal voor bubbels in een breed pH-bereik, suggereert dit dat OH- effectiever is dan H+ om de microscopische structuur van het gas-water-grensvlak te beïnvloeden.
Alcohol heeft een negatieve invloed op ultrafijne bubbels
Alcohol zowel methanol, ethanol als hogere alcoholen hebben een negatief effect op het zeta-potentiaal door de negatieve waarde te verlagen. De alcoholen hebben de neiging om de gas-water interface te absorberen en het toevoegen van een kleine hoeveelheid alcohol verstoorde het waterstofbindingsnetwerk aan de interface aanzienlijk.
Voor de stabiliteit van bubbels bleek uit wat ouder onderzoek dat luchtbellen 4 dagen stabiel waren in oplossing, terwijl CO2-bellen slechts 1 of 2 uur aanhielden. Meer recente studies hebben aangetoond dat ultrafijne bubbels in een laboratorium onder perfecte omstandigheden 4 tot 6 maanden stabiel zijn.
Colloïden Stabiel en onstabiel
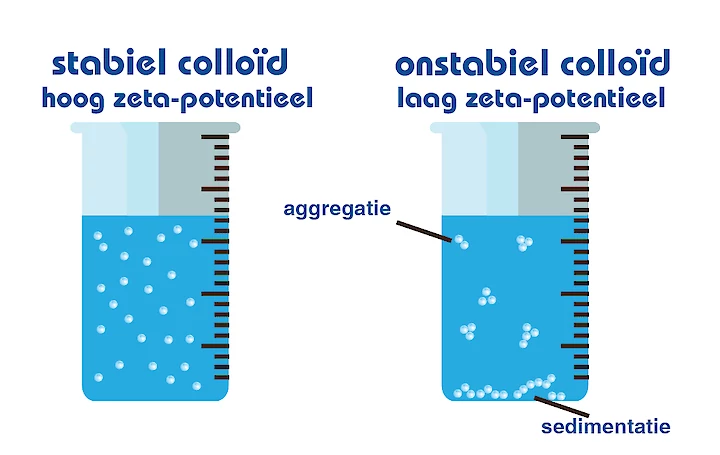
Mensen vragen zich vaak af of ultrafijne bubbels zich gelijkmatig door het water verspreiden of dat ze in een bepaald deel van het water zijn geclusterd. Bubbels gedragen zich hetzelfde als deeltjes in een colloïd. Een colloïd is een oplossing met deeltjes met een diameter tussen 1 en 1000 nanometer en kan nog steeds gelijkmatig over de oplossing verdeeld blijven. Deze worden ook wel colloïdale dispersies genoemd omdat de stoffen verspreid blijven en niet op de bodem van de container terechtkomen. Elk colloïdaal deeltje dat in de oplossing is gedispergeerd, wordt elektrisch geladen vanwege hun ionische kenmerken en bipolaire eigenschappen.
Zeta-potentiaal in de praktijk en toepassingen
Tuinbouw en landbouw
Een hoog zetapotentiaal betekent een stabiele oplossing voor plantenwortels, dit is positief omdat ze gemakkelijker voedingsstoffen kunnen opnemen door een grotere kans op opname. Een voedingsoplossing voor planten met een laag zetapotentiaal laat geclusterde voedingsstoffen zien die minder toegankelijk zijn voor plantenwortels.
Sanering van meren en vijvers
Probiotische bacteriën zijn een belangrijk onderdeel voor het reinigen van afvalwater, het reinigen van meren en vijvers en het reinigen van septic tanks. De probiotische bacteriën zijn aëroob, ze hebben zuurstof nodig als energiebron en hoe meer zuurstof hoe beter. Een probiotische bacterie heeft een afmeting tussen 200 nm en 10.000 nm vergeleken met een gemiddelde acniti nano-bubbel tussen 85 en 120 nm. De probiotische bacteriën verzamelen voedingsstoffen uit de omgeving door diffusie. Een hoge zuurstofconcentratie in het water met een hoog zetapotentiaal helpt deze positieve bacteriën te gedijen. Met een hoog zetapotentiaal worden de voedingsstoffen voor de probiotische bacteriën goed verspreid door de oplossing en zijn ze gemakkelijk toegankelijk. Wanneer de wateroplossing een lage zeta heeft, worden potentiële voedingsstoffen minder toegankelijk geclusterd en duurt het langer voordat de probiotische bacteriën het waterlichaam opruimen.
Waterbehandeling
In het waterbehandelingssysteem geeft monitoring van het Zeta-potentiaal een indicatie voor de hoeveelheid chemicaliën of ultrafijne bubbels die moeten worden gedoseerd.
Biofilm en bio-fouling
De toename van de zetapotentiaal van buizen en pijpen elimineert biofilm en biofouling van membranen en verlengt de levensduur van het filter.
Slib
Stabiliseer klei en andere deeltjes in water, waardoor de neiging tot aggregatie wordt verminderd, zodat ze niet als zacht slib bezinken.
Vrije radicalen
Wanneer nanobubbels bij hoge concentraties worden gecomprimeerd, zal de zetapotentiaal tijdens compressie toenemen en neemt de ionenconcentratie rond de bubbels toe. Na enkele minuten compressie worden er zoveel toegangsionen gevormd dat er vrije radicalen ontstaan.







